Le succès de l'utilisation de vecteurs viraux pour introduire une charge moléculaire dans une cellule ou remplacer des gènes défectueux par des gènes fonctionnels est un point d'inflexion dans l'avenir de la médecine moderne.
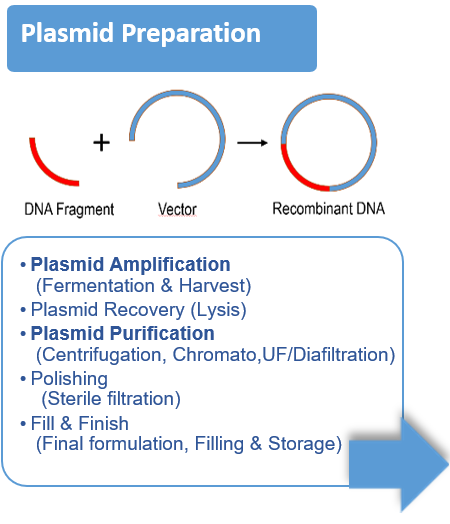
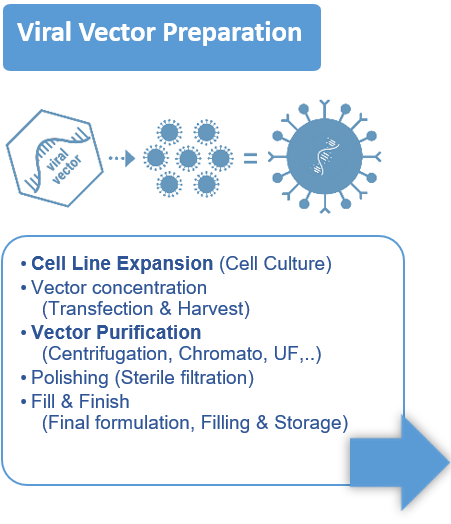
La production de vecteurs est un flux de travail complet comprenant :
- Conception de vecteurs, expansion cellulaire, transfection / infection, lyse cellulaire, récolte / clarification, concentration, capture, polissage, formulation, filtration stérile.
- La plupart du temps, le vecteur est un virus (AAV, Lentivirus, ...), un plasmide, mais il peut également s'agir d'une vésicule extracellulaire.


Vos défis en matière de production de vecteurs
- Manipulation de virus ou d'agents pathogènes dans des conditionssûres?
- Votre méthode de caractérisation de la charge de la capside est-elle robuste, fiable et validée ?
- Comment peut-on augmenter la pureté du vecteur ?
- Votre méthode de comptage cellulaire et d'analyse de la viabilité est-elle facile et fiable ?
Demandez à nos experts
Nos solutions pour votre flux de travail vectoriel
- Prélèvement d'air pour la surveillance des particules viables dans les salles blanches
- Manipulation automatisée des liquidesManipulation automatisée des liquides sans contact
- Biomasse par spectrophotométrie
- Bioréacteur
- Compteur de cellules automatisé pour bioréacteurs & analyseurs de viabilité
- Santé des milieux des bioréacteurs bioanalyseur
- Cabinet de sécurité biologique
- Electrophorèse capillaire (CE) pour la pureté des plasmides, l'analyse des protéines virales, la quantification des capuchons vides/pleins, l'intégrité du génome.
- Prélèvement de cellules
- Centrifugeuses Biosafe, consommables de centrifugation et accessoires
- Incubateur à CO2, Incubateur à agitation
- Désinfection
- Méthodes manuelles Elisa avec lecteur de microplaques et laveur de microplaques
- Solutions automatisées Elisa, 10 points à prendre en compte pour l'automatisation ELISA
- Cytomètre en flux
- Réfrigérateurs, congélateurs et surgélateurs +4°C à -80°C, N2 liquide
- Conservation cryogénique
- Imagerie pour le Western blot
- Incubateurs agitants
- Configuration de la PCR, Armoire PCR
- Pipette
- Préparatoire Ultracentrifugeuse, Ultracentrifugeuse analytique (AUC)
- Charge en capside du vecteur viral par ultracentrifugation analytique (AUC) ou par Electrophorèse capillaire (EC)
- Taille, forme et structure des vecteurs viraux par analyse
- Ultracentrifugation (AUC), par Electrophorèse capillaire (EC) ou par diffraction laser (LS)
- Stérilisation à la vapeur
-
Bain marie
Pour rappel, la thérapie génique consiste généralement à insérer du matériel génétique dans les cellules par l'intermédiaire d'un vecteur viral inoffensif qui "infecte" la cellule et délivre la charge utile génétique. Des méthodes analytiques sont nécessaires pour tester les matières premières, contrôler les processus en cours et démontrer la qualité du lot de vecteurs viraux. Les lots de vecteurs viraux GMP fabriqués pour les essais cliniques doivent être conformes à un nombre croissant de réglementations mondiales.
L'un des vecteurs les plus populaires pour le conditionnement est le virus adéno-associé (AAV), qui présente deux avantages clés : l'efficacité en tant que vecteur de transfert de gènes et une faible pathogénicité. Le virus a été modifié par rapport au type sauvage afin d'optimiser son efficacité en tant que vecteur de gènes thérapeutiques et de minimiser son potentiel pathogène. L'AAV recombinant est aujourd'hui la principale plateforme de thérapie génique.
Il est essentiel de créer des produits sûrs qui peuvent être mis à l'échelle - et qui conservent leur sécurité. L'élément important dans la fabrication de produits de thérapie génique est la pureté, c'est-à-dire l'efficacité du "conditionnement" pour l'administration dans la cellule. Un mauvais conditionnement peut conduire à une thérapie moins efficace. De plus, l'administration de doses plus élevées de thérapie pour compenser un mauvais conditionnement risque de déclencher une réaction allergique chez le patient. La FDA a publié un guide , et l'étude de cas sur les essais cliniques aborde l'importance de cette question.
Tous les principes développés ici sont bien sûr utilisés dans de nombreux autres médicaments de thérapie innovante (ATMP) que les immunothérapies. Il est également important de souligner qu'après la période COVID19, les nanoparticules lipidiques(LNP) sont un vecteur plus courant de matériel génétique comme les ARN messagers (ARNm).
Développement & Production de vecteurs viraux:
Progrès dans les processus et la traduction pour la thérapie génique humaine
Comprendre le rôle des vecteurs viraux dans la recherche génétique moderne et comment l'ultracentrifugation est utilisée pour produire ces systèmes d'administration clés.
Christine Le Bec - Méthodes analytiques pour mesurer les particules AAV vides & pleines
Examen des techniques de caractérisation biophysique et de l'utilisation de l'ultracentrifugation analytique (AUC) pour mesurer les particules AAV vides et pleines.
CRISPR pour l'immunothérapie : Introduction & Vue d'ensemble
Vidéo sur l'introduction de CRISPR pour l'immunothérapie.
Sources et références:
Hacein-Bey-Abina, S., Hauer, J., Lim, A., Picard, C., Wang, G. P., Berry, C. C., Martinache, C., Rieux-Laucat, F., Latour, S., Belohradsky, B. H., Leiva, L., Sorensen, R., Debré, M., Casanova, J. L., Blanche, S., Durandy, A., Bushman, F. D., Fischer, A., & ; Cavazzana-Calvo, M. (2010). Efficacité de la thérapie génique pour le déficit immunitaire combiné sévère lié à l'X. The New England journal of medicine, 363(4), 355-364.
https://doi.org/10.1056/NEJMoa1000164
Kaeppel, C., Beattie, S. G., Fronza, R., van Logtenstein, R., Salmon, F., Schmidt, S., Wolf, S., Nowrouzi, A., Glimm, H., von Kalle, C., Petry, H., Gaudet, D., & ; Schmidt, M. (2013). Un profil d'intégration AAV largement aléatoire après la thérapie génique LPLD. Nature medicine, 19(7), 889-891.
https://doi.org/10.1038/nm.3230
Masat, E., Pavani, G., & ; Mingozzi, F. (2013). Immunité humorale aux vecteurs AAV dans la thérapie génique : défis et solutions potentielles. Discovery medicine, 15(85), 379-389.
Mingozzi, F., & ; High, K. A. (2013). Immune responses to AAV vectors : overcoming barriers to successful gene therapy (Réponses immunitaires aux vecteurs AAV : surmonter les obstacles à une thérapie génique réussie). Blood, 122(1), 23-36.
https://doi.org/10.1182/blood-2013-01-306647
Joshi, P., Cervera, L., Ahmed, I., Kondratov, O., Zolotukhin, S., Schrag, J., Chahal, P. S., & ; Kamen, A. A. (2019). Obtention d'une production à haut rendement de vecteurs de libération de gènes AAV5 fonctionnels via Fedbatch dans un système de baculovirus Insect Cell-One. Thérapie moléculaire. Methods & ; clinical development, 13, 279-289.
https://doi.org/10.1016/j.omtm.2019.02.003